Adina Ionescu Muscel - Art photography and mixed media
Experimental techniques to record matter
Inter-acting












Ces expériences sont non seulement un joli gadget, mais aussi d'un grand intérêt chimique, biologique et géologique.
En chimie, des espaces de réaction périodiques sont observés dans les réactions oscillantes. En biologie aussi, la croissance des micro-organismes est souvent liée aux oscillations et aussi au phénomène de Liesegang. [3]
En géologie, l'exemple de la silice est particulièrement clair. C'est ainsi que se forment les couches de silex du Crétacé supérieur selon des principes similaires (Fig. 2) [2]. Leur genèse correspond le mieux à la partie A de l'expérience avec l'éprouvette.
https://www.chemieunterricht.de/dc2/tip/03_98.htm
Expérience : les anneaux de Liesegang expérience étudiante; 20 min.
Matériel
Bécher (100 ml),
tige de verre,
bain-marie (70 °C),
éprouvettes,
loupe,
boîte de Pétri.
Produits chimiques
Solution de dichromate de potassium (w = 0,2 % ; T),
solution de nitrate d'argent (w = 10 % ; C),
gélatine.
Procédure
Demandez à votre professeur de vous donner une solution aqueuse de dichromate de potassium (w = 0,2 % ; T). un) expérience de tube à essai
Dissoudre la gélatine (w=20%) dans la solution de bichromate. Il faut le chauffer un peu. Versez environ 10 ml de la solution encore chaude dans un tube à essai et laissez bien refroidir le mélange. (Comme cela peut prendre plus de temps, vous devez laisser le mélange toute la nuit.)
Étalez un volume égal de solution de nitrate d'argent sur la gélatine et placez le mélange dans une armoire sombre sans secouer (les sels d'argent sont connus pour être sensibles à la lumière !). Regardez le tube à essai le lendemain et quelques jours plus tard. La loupe est utile.
b) Expérience dans la boîte de Pétri Dissoudre la gélatine (w=15%) dans la solution de bichromate. Il faut le chauffer un peu. Verser la solution dans une boîte de Pétri, en couvrant juste le fond. L'épaisseur de la couche ne doit pas dépasser 1 mm. Laissez bien refroidir le mélange. (Comme cela peut prendre plus de temps, vous devez laisser le lot toute la nuit.)
Dans la boîte de Pétri, déposer une grosse goutte de solution de nitrate d'argent au centre de la couche de gélatine. Avec précaution, sans laisser couler la goutte, placez la boîte de Pétri dans un dessiccateur, que vous devez conserver dans une pièce sombre. Les anneaux se forment particulièrement bien si vous ajoutez plus de solution à des intervalles d'environ une heure selon les besoins. Regardez l'échantillon le lendemain et les jours suivants. Continuez à ajouter une solution de nitrate d'argent. Regardez aussi le bol d'en bas.
Résultat
Vous pouvez voir des couches de précipitations dans le tube à essai ; De jolis anneaux de précipitation se forment dans la boîte de Pétri (Fig. 1).
Remarque
Il existe d'autres recettes pour les anneaux de Liesegang [1]. Cependant, ceux-ci ne fonctionnent pas aussi bien que le système présenté.

Le phénomène de précipitation dans les solutions dans lesquelles il est difficile d'égaliser les concentrations par mélange et convection a été décrit dès le milieu du XIXe siècle (Friedlieb Ferdinand Runge en 1855), mais la recherche systématique de cet effet n'a été entreprise qu'à la fin de le siècle par Raphael Eduard Liesegang. En 1896, il remarque que des cercles concentriques de précipité sombre de chromate d'argent(VI) AgCrO4 se forment autour d'un cristal de nitrate d'argent(V) AgNO3 placé à la surface d'une solution gélatineuse de bichromate de potassium(VI) K2Cr2O7. Friedrich Wilhelm Ostwald prix nobel de la chimie et personnage intéressant expliquera pourquoi.
https://mlodytechnik.pl/eksperymenty-i-zadania-szkolne/chemia/1106-pierscienie-lieseganga
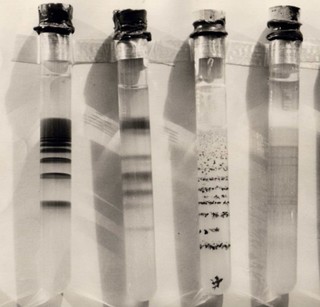
Les anneaux de Liesegang
chimiste et photographe











Chromatography
Spectroscopy
Self-grown pictures
Mikhail Sémionovitch Tswett - first to use absorption chromatography
His russian name means both Colour and Flowering
The physical interpretation of the adsorption phenomena that we have considered will be discussed elsewhere. However, here we can mention some related regularities and the resulting applications. The adsorption material saturated with a pigment can still take up another member of a certain mixture and hold it firmly. Substitution can also occur. For example, the xanthophylls can be partly displaced from their adsorption compounds by the chlorophyllines, but not the reverse. There is a definite adsorption series according to which the substances can substitute. The following important application comes from this rule. If a petroleum ether solution of chlorophyll filters through a column of an adsorption material (I use chiefly calcium carbonate which is firmly pressed into a narrow glass tube), the pigments will separate according to the adsorption series from above downward in differently colored zones, and the more strongly adsorbed pigments will displace the more weakly held ones which will move downward. This separation will be practically complete if, after one passage of the pigment solution it is followed, by a stream of pure solvent through the adsorbing column. Like the light rays of the spectrum, the different components of a pigment mixture in the calcium carbonate column will be separated regularly from each other, and can be determined qualitatively and also quantitatively. I call such a preparation a chromatogram and the corresponding method the chromatographic method. In the near future I will give a later report on this. It is perhaps not superfluous to mention here that this method in its principle and also in the exceptional ease of carrying it out has nothing to do with so-called capillary analysis.
https://web.lemoyne.edu/~giunta/tswett.html
Phytograms

JavaScript is turned off.
Please enable JavaScript to view this site properly.